Pandemie onemocnění Covid-19 zaplavila sdělovací prostředky spoustou pojmů, se kterými se předtím setkávali ve větší míře jen odborníci. Ještě před rokem jsme si nemuseli lámat hlavu s tím, co jsou vlastně viry a jak se liší od patogenů, jak funguje náš imunitní systém a čím se liší buněčná a humorální imunita, na jakých principech jsou postaveny PCR, antigenní a protilátkové testy, kde se berou teď tolik skloňované mutace, a proč na ně některé vakcíny zabírají a jiné ne.
Teda, ne že by teď bylo nutné se tím až tak trápit. Bezesporu lze v pohodě žít s velmi povrchním porozuměním tomuto informačnímu chaosu a nežinýrovat se. Ostatně není pro běžný život mnohem důležitější sledovat aktuální vládní opatření, než třeba pitvat typy imunitní response?
Jenže když člověk ani neví, co vlastně je a jak funguje vir — a jak jsem nedávno zjistil, neví to ani mnozí technicky vzdělaní vysokoškoláci, kteří měli biologii naposledy na střední škole — je v nemalé informační nevýhodě. Když nerozumím virům, neznám svého nepřítele. Nemám šanci nějak, byť laicky, zhodnotit nebezpečí mutací, ani pochopit, jak doma účinně zvednout svoji imunitu. Těžko můžu hlouběji pochopit mechanismus účinku vakcín, tím méně aspoň trochu kvalifikovaně posoudit, jestli je rozumné na ně spoléhat nebo ne. To vše může vzbuzovat nemalý strach a nejistotu, za které je obtížné plánovat útraty, investice nebo dovolenou.
Jedna neznalost vede k další a každá další nejistotu a strach stupňuje. A zprávy masových médií psané ve chvatu a pod tlakem profesionálními novináři, kteří sami nejsou v biologii odborníky, ke snížení této nejistoty příliš nepomáhají.
Rozhodl jsem se proto zařadit do seriálu Faktomluva o Covidu i základní kapitolu z mikrobiologie, ve které se pokusím laicky přijatelným způsobem podat to nejdůležitější, co si myslím, že je dobré o viru SARS-COV-2 vědět. Zájemce by to mělo vybavit dostatečně na to, aby daleko lépe rozuměli nejen našim epidemiologům a imunologům, ale byli schopni přečíst i odbornou studii o Covidu v některém z medicínských časopisů, bez toho, že by se úplně ztratili v záplavě odborné terminologie.
Nejsem biolog, ale je známo, že k popularizaci vědy jsou nejlepší odborníci z jiných odvětví (tento názor sdílím např. s Charlesem Murrayem, který, ač sociolog, napsal skvělou knihu o molekulární genetice Human Diversity). Experti přímo z oboru často nedokáží překročit hranice odborného žargonu, stejně jako širokou propast dělící laiky a je samotné.
Je samozřejmě možné, že jelikož nejsem odborník, budou v mém popisu faktické nepřesnosti, jakkoliv jsem se jich snažil maximálně vyvarovat. Pokud někdo z odborně zdatných čtenářů na nějakou takovou nepřesnost narazí, budu rád, když mi dá vědět.
Snad bude moje resumé aspoň trochu prospěšné. A i kdyby ne, já sám jsem se na této cestě dozvěděl tolik nového, že mi to za to stálo.
Začněme od toho, co jsou vlastně viry.
(doba čtení: 15:21)
Co jsou to vlastně viry
Viry jsou miniaturní, velmi primitivní organismy na pomezí živého a neživého. Velikost většiny virů se pohybuje mezi 20-400 nm (pro srovnání, tloušťka lidského vlasu je 17-180 µm, tedy 100-10 000x více). Původ a evoluce virů je nejasný, ale má se za to, že se vyvinuly paralelně se vznikem buněk.
Na jedné straně viry s živými organismy spojuje stejný genetický základ, jmenovitě RNA (nebo, v menším počtu případů, DNA). Na straně druhé, na rozdíl od živých organismů neumějí viry genetickou informaci samy „přečíst“ a „použít“. V důsledku toho se nejsou schopny samy, bez pomoci, rozmnožovat (což je bezesporu vlastnost živého organismu; odtud tedy spory o tom, jestli jsou viry vůbec živé).
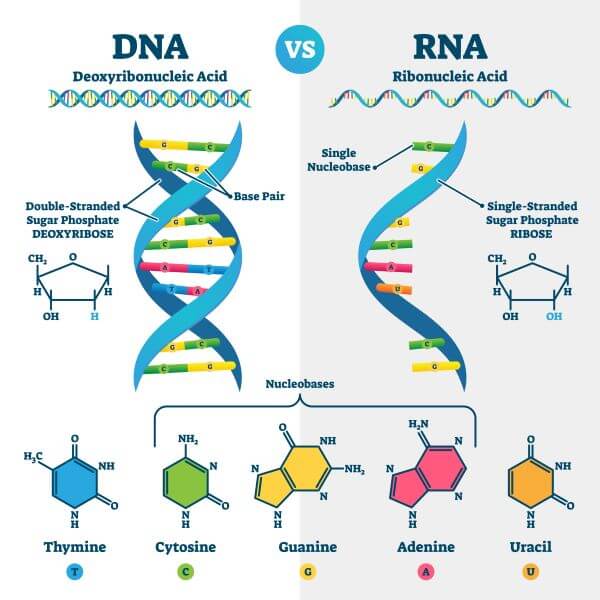
Abychom tohle pochopili, musíme se na chvíli zastavit u toho, jak funguje DNA a RNA. Nejprve pár slov ke skladbě těchto kyselin. Obě kyseliny mají podobnou strukturu i účel. V obou případech jde o biopolymer složený z jakési „kostry“ — cukrovo-fosfátové báze (ribóza nebo deoxyribóza střídající se s fosfátovou skupinou), na kterou nasedají „informační jednotky“ nazývané nukleotidy. V případě DNA jde o nukleotidy adenin (A), guanin(G), cytosin (C) a thymin (T), v případě RNA je thymin nahrazen uracilem (U). Hlavní rozdíl je v tom, že DNA je dvouvláknová a jednotlivé nukleotidy jsou v ní spojeny v komplementárních párech A-T a C-G, zatímco RNA je jednovláknová a její nukleotidy nejsou přímo nikam navázané:
Zdroj: zde
Obě kyseliny jsou nositelky genetické informace. Můžeme si je představit jako svého druhu diskety (nebo flash paměti—pro později narozené 😉), kde je uložen návod, podle kterého se pak staví a opravuje celý živý organismus. Zatímco ovšem na skutečné disketě je vše zakódováno pomocí nul a jedniček, v DNA/RNA jsou pro kódování k dispozici čtyři různé nukleotidy. A protože živé organismy jsou postaveny především z proteinů, je možno DNA i RNA chápat jako kuchařku k syntéze konkrétních proteinů. Rozdíl je v tom, že DNA je nositelkou genetické informace u buněčných organismů (od baktérií až po organismy mnohobuněčné) a u DNA virů, zatímco RNA nese genetickou informaci pouze a jen u RNA virů. Krom toho RNA vzniká jako meziprodukt v procesu dekódování DNA, a to i u mnohobuněčných organismů, jak si vysvětlíme níže.
Když mluvíme o genetické informaci, měli bychom si také říct, co je gen. Gen je základní jednotka dědičnosti a může být tvořen stovkami až miliony nukleotidů.
Proces dekódování genetické informace a jejího „použití“ k syntéze proteinu (biologové tomu říkají genová exprese) obvykle probíhá následovně. Nejprve dojde k tzv. transkripci, při níž z DNA vznikne RNA. Klíčovou roli jakési „čtečky“ a „dekodéru“ při tom hraje enzym, který se jmenuje RNA polymeráza. DNA se nejprve rozdělí na dvě vlákna. RNA polymeráza se naváže na začátek prvního genu a začne na nukleotidy DNA připojovat komplementární nukleotidy RNA (například řetězec DNA v podobě A-T-C se do RNA přepíše jako U-A-G). Když se do RNA přepíše celý jeden gen, vzniklá jednořetězcová molekula RNA se odpojí a proces dekódování DNA pokračuje dalším genem. Z výsledné molekuly RNA v procesu, kterému se říká translace, je pak syntetizována konkrétní bílkovina. Této RNA, která je použita přímo k syntéze bílkovin, se říká mediátorová RNA (mRNA; je to právě tahle mRNA, na které je založena vakcína firmy Pfizer). Kromě ní ještě mohou v transkripci vzniknout i jiné druhy RNA, které bílkoviny přímo nekódují, a mají odlišné, namnoze pomocné funkce.
Transkripce a translace probíhá pouze v živých, metabolicky aktivních buňkách. Konkrétně transkripce obvykle v buněčném jádře a translace v ribozomech. Viry tento rozmnožovací a stavební aparát nemají. Jejich rozmnožování probíhá tak, že zneužijí nějakou buňku a donutí ji, aby namísto své vlastní DNA dekódovala RNA viru a vzniklou informaci použila k syntéze virových bílkovin.
Zjednodušeně si tento proces můžeme představit následovně: jedna virová částice se přichytí k vybrané buňce, pronikne do ní, rozbalí se a obnaží svůj genetický materiál. Poté složitými chemickými procesy „obalamutí“ buňku tak, aby začala namísto vlastní DNA replikovat její RNA/DNA. Tím dojde k syntéze nových virových částic, které posléze buňku opustí. Buňka pak obvykle umírá a proces šíření viru, tedy infekce, zdárně pokračuje. Kompletní životní cyklus většiny virů od vstupu do buňky až po uvolnění nových virových částic trvá od 30 min do několika málo dní. V jedné infikované buňce takto vznikne 1 000 až 100 000 nových virionů (virových částic).
Žádný virus se však nemůže množit v libovolné buňce. Viry jsou poměrně vybíravé, většina z nich si vybírá konkrétní buňku konkrétního hostitelského organismu (např. teď tak často zmiňovaného netopýra 😊). Ani v rámci jednoho hostitele nejsou všechny buňky stejně vhodné: u tzv. nevnímavých buněk se reprodukční cyklus viru vůbec nezahájí, u tzv. nepermisivních buněk je přerušen předčasně.
Některé viry mají velmi úzký okruh hostitelů, jiné poměrně široký. A jací že jsou hostitelé viru SARS-Cov-2? Zatím bylo prokázáno, že od člověka mohou Covid-19 chytit domácí zvířata, jmenovitě kočky a psi. V laboratoři se podařilo nakazit i řadu dalších savců, například opice, fretky nebo křečky.
Virus SARS-Cov-2
Virus SARS-Cov-2 patří mezi tak zvané velké obalené RNA viry. Má kulovitý tvar a taxonomicky patří do čeledi koronavirů. Název této čeledi se odkazuje na sluneční koronu, kterou všechny koronaviry vzdáleně připomínají. Do čeledi koronavirů patří vícero virů způsobujících rýmu, nemoci z nachlazení nebo záněty horních cest dýchacích. Nejznámějšími zástupci kororonavirů jsou kromě SARS-Cov-2 virus MERS-Cov, původce onemocnění MERS, a virus SARS-Cov, který stojí za onemocněním SARS.
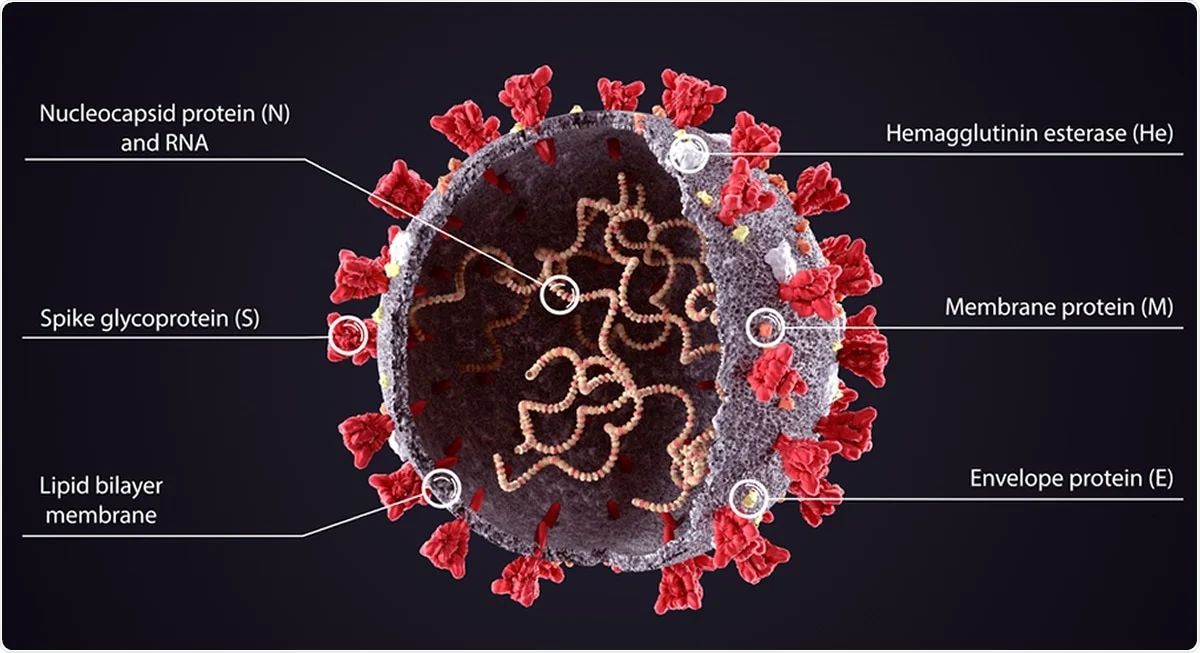
Virus SARS-Cov-2 má okolo 50-200 nm v průměru a skládá se z chuchvalečku RNA chráněného bílkovinným obalem neboli nukleokapsidou. Obojí je dále „zabaleno“ v obálce (envelope) tvořené virovou membránou. Ta se skládá převážně z fosfolipidů a několika druhů membránových proteinů. Tvar a stavbu viru SARS-Cov-2 dobře ilustruje následující obrázek (zdroj), ve kterém jsou vypíchnuty i základní membránové proteiny S, M, E a nukleokapsidový protein N:
Z hlediska genetiky je SARS-Cov-2 virem s jednovláknovou RNA s tzv. pozitivní polaritou (positive-sense single-stranded RNA). Výraz pozitivní polarita si vysvětlíme si později.
Reprodukční cyklus viru SARS-Cov-2
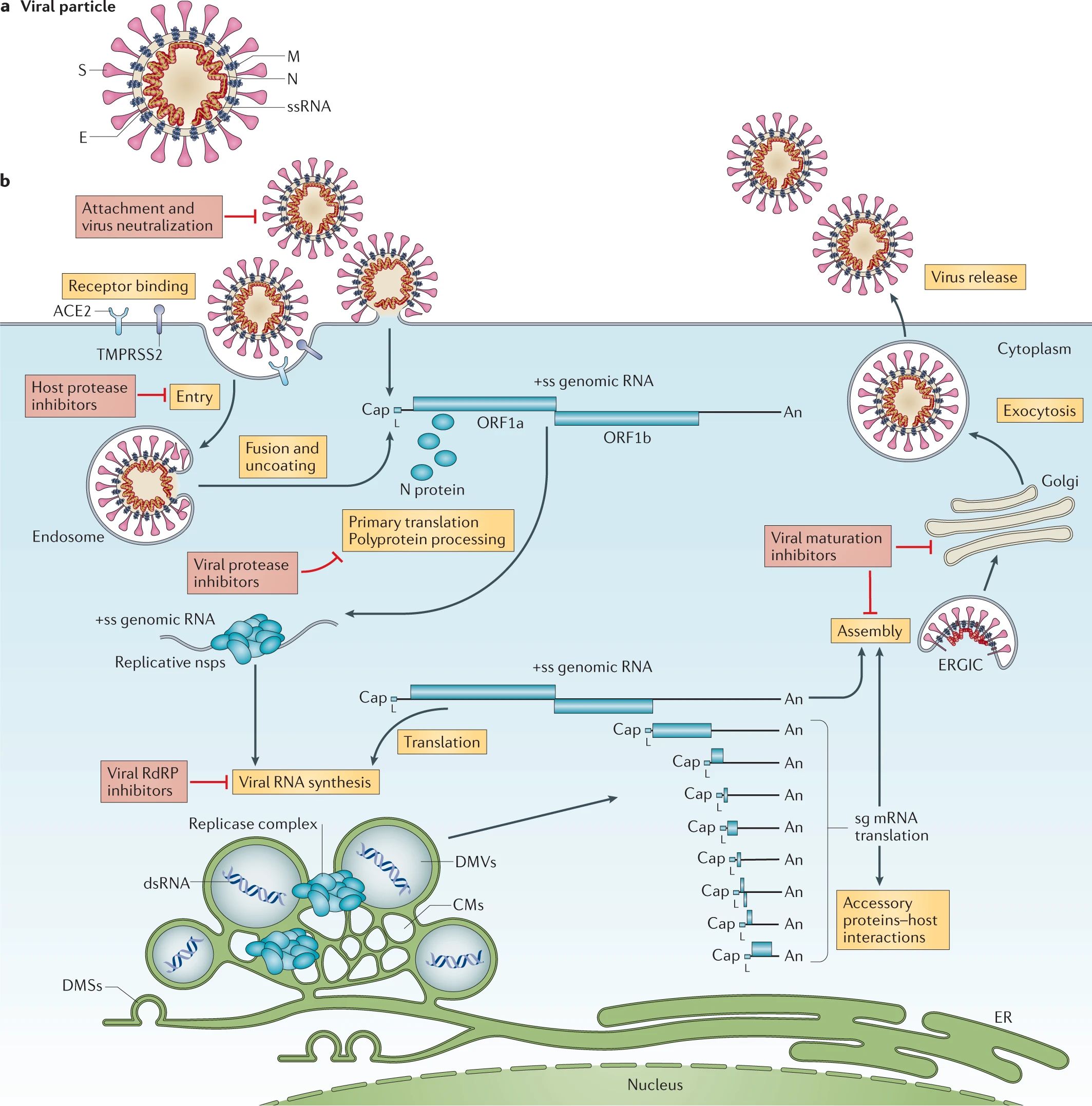
Reprodukční cyklus viru SARS-Cov-2 se skládá ze šesti fází, které si postupně detailně rozebereme.
1. Navázání viru na vnímavou buňku (adsorpce)
V této fázi virus atakuje povrch vnímavé buňky hostitelského organismu a naváže se na ni. Vnímavá hostitelská buňka musí virus rozpoznat a nějak mu „umožnit vstup“. O to se postará některý z tzv. buněčných receptorů, fungujících jako pomyslný dveřník. Receptor je specifický protein na povrchu buňky, který má schopnost vázat nějakou konkrétní molekulu (hormon, neurotransmitter, povrchový protein viru…) a který po takovémto navázání vyvolá konkrétní biologickou odpověď buňky. Jednou z takových odpovědí může být třeba právě nastartování reprodukčního cyklu viru.
Různé receptory se selektivně vážou na různé molekuly způsobem, který si lze představit jako zámek vs. klíč. V případě viru SARS-Cov-2 je takovým „zámkem“ receptor ACE2 (angiotenzin-konvertující enzym 2). „Klíčem“ na straně SARS-Cov-2 je pak receptor-vazebné místo (RBD, alias receptor-binding domain) spike proteinu. Ve srovnání s virem SARS-Cov, RBD viru SARS-Cov-2 „zapadá“ do ACE2 lépe, což vede k pevnějšímu „přisátí“ viru k povrchu buňky. A tedy většímu riziku, že se infekce rozvine do šířky.
Receptory ACE2 se v lidském těle vyskytují v buňkách krevních a lymfatických cév, ledvin, srdce, plic, tenkého střeva, placenty a varlat. Normální funkcí ACE2 je tlumit zánětlivé procesy v krvi a předcházet poškození, zejména plicních sklípků. SARS-Cov-2, který se na ACE2 váže, tuto přirozenou funkci blokuje, čímž otevírá dveře zmíněným poškozením tkání a orgánů. Ne všichni lidé mají stejné množství ACE2. Uvádí se, že toto množství zvyšují některá onemocnění, např. vysoký krevní tlak, cukrovka nebo kardiovaskulární onemocnění. Souvislost mezi množstvím ACE2 a průběhem onemocnění Covid-19 ale není jasná.
Na průběh adsorpce má vliv řada faktorů, jako např. fyziologický stav buněk, pH prostředí nebo koncentrace konkrétních iontů (z toho mimochodem plyne, že průběh onemocnění Covid-19 lze ovlivňovat širokou škálou běžných prostředků, od stravy až po potravinové doplňky).
2. Průnik viru do buňky (penetrace) a jeho rozbalení
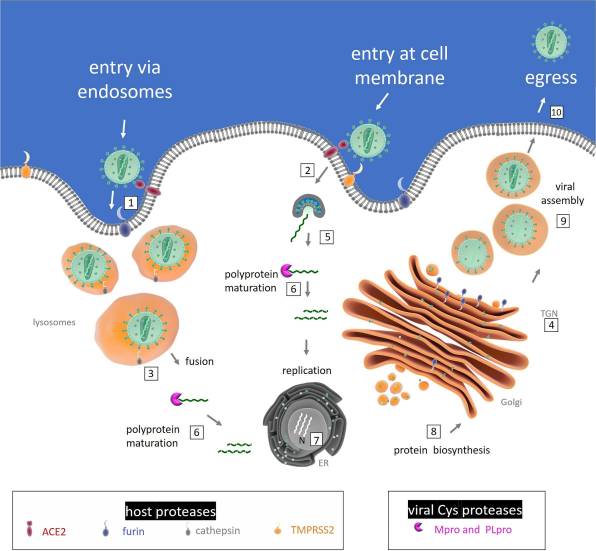
V této fázi cyklu dochází k „otevření dveří“ a průniku viru do hostitelské buňky. U viru SARS-Cov-2 to může proběhnout dvěma způsoby. V obou případech dojde k fúzi (splynutí) plazmatických membrán viru a buňky v procesu, který se nazývá endocytóza (odborně a přesněji tzv. endocytóza zprostředkovaná již zmíněným receptorem ACE2; ACE2-medidated endocytosis). Endocytóza je pro buňky běžný proces, který je využíván při transportu nejrůznějších velkých molekul, které neprojdou buněčnou membránou, dovnitř buňky.
V prvním případě dojde ke vchlípení povrchové membrány buňky, takže vznikne jakýsi váček (endozóm), který nasaje okolní tekutinu včetně virové částice. V tomto případě se do nitra buňky dostane virová částice neporučená, a její dezintegrace—tedy obnažení RNA—probíhá až následně uvnitř buňky v lysozómech.
Ve druhém případě je povrchová membrána viru narušena ještě vně buňky a do buněčné cytoplasmy je uvolněna pouze RNA viru, chráněná nukleokapsidou.
V obou případech se na transportu viru dovnitř buňky — alias na „infekci“— aktivně podílí buňka sama, a to pomocí enzymů nazývaných proteáza (pro fajnšmekry: jde o eznymy furin a cathepsin v případě prvním, a o enzym TMPRSS2 v případě druhém). Po využití receptoru ACE2 je to další příklad toho, jak se viru daří zneužít aparát nic netušící buňky.
Dobře oba typy průniku viru do buňky ilustruje tento obrázek (zdroj):
Několik hodin po průniku viru do buňky se zdá, že se z pohledu hostitelského organismu nic neděje. První fáze infekce buňky jsou totiž spojeny s pochody probíhajícími na molekulární úrovni bez přímého poškození buňky. Tuto fázi nazýváme ekliptickou fází (eclipse phase). Ekliptická fáze je ukončena vznikem první virové částice v buňce. Následuje produktivní fáze, během které jsou tvořeny nové virové částice a ty dále uvolňovány z buňky.
3. Transkripce
Obnažená RNA SARS-Cov-2 musí být přeložena neboli transkribována do mRNA, která — jak jsme si uvedli v úvodu výše —je dále použita k syntéze bílkovin. U virů s jednovláknovou RNA s pozitivní orientací ale tato fáze odpadá, jelikož jejich RNA může být použita k syntéze proteinů přímo (to je rozdíl oproti virům s negativně orientovanou RNA).
4. Překlad virové RNA (translace)
V této fázi virus uchvátí translační aparát v ribozomech hostitelské buňky a zneužije jej k výrobě vlastních bílkovin. Nejprve je syntetizován tzv. polyprotein, který se dále štěpí na jednotlivé funkční a strukturní proteiny. Funkční (nestrukturní) proteiny—tj. enzymy a regulační proteiny—vznikají nejdříve, obvykle několik minut po infekci, protože dále moderují a řídí celý proces replikace viru. Mezi první syntetizované funkční proteiny patří virové proteázy, konkrétně proteáza 3CLpro a proteáza PLpro. Proteáza 3CLpro facilituje další štěpení polyproteinu, zatímco proteáza PLpro štěpí některé proteiny hostitelské buňky podílející se na její imunitní responsi a tím oslabuje její obranné mechanismy. Nestrukturní proteiny také vyvolávají vznik membránových sklípků, často vzájemně propojených do složitějších struktur, tzv. DMVs (Double Membrane Vesicles). Právě v těchto sklípcích pak probíhají popisované chemické procesy. Strukturní proteiny—tedy ty, které se podílejí na stavbě nové virové částice (proteiny kapsidy, membránové proteiny, receptorové proteiny) — vznikají později.
Rozštěpením polyproteinu zmíněnými proteázami vznikne tzv. komplex replikázy-transkriptázy (replicase-transciptase complex, neboli RTC komplex) obsahující celkem 16 „malých“ nestrukturních proteinů. V literatuře jsou označovány jako Nsp1 až Nsp16. Jejich funkce je velmi různorodá a v některých případech není ještě zcela rozluštěna. Některé z těchto proteinů napomáhají přichycení celého komplexu k buněčným membránám uvnitř buňky, a tím připravují půdu pro replikaci virové RNA. Několik z nich přímo katalyzují syntézu nové RNA, např. tzv. RNA transpriptáza. Další se podílejí na konstrukci nových virionů a jejich vypuštění z buňky. Vyčerpávající popis všech dílčích proteinů RTC komplexu, jejich přesné role a vzájemné souhry lze najít zde. Asi nejdůležitější protein je Nsp12, již zmíněný enzym RNA polymeráza, taktéž označovaný jako RdRp (RNA-dependent RNA polymerase), mající funkci čtečky RNA nezbytné pro její replikaci. Důležitý je též protein Nsp14, který, společně s Nsp10, má v jistém smyslu kontrolní funkci. Oba proteiny vymazávají z již syntetizovaných částí RNA chybně zkopírované nukleotidy, čímž snižují četnost mutací a také oslabují imunitní responsi buňky, která by mohla chybně syntetizované úseky RNA snáze rozpoznat jako „cizí“ a pokusit se je zničit.
Vzniklé strukturní proteiny se skrze membrány endoplazmatického retikula dostávají do Golgiho aparátu, kde interagují s nově vzniklými kopiemi virové RNA. Jak vznikají tyto kopie RNA popisuji dále.
5. Replikace virové RNA
Kromě toho, že virus potřebuje hostitelskou buňku „donutit“ k syntéze svých vlastních bílkovin, které budou posléze použity k výstavbě nových virionů, musí si také zajistit výrobu dostatečného počtu kopií své vlastní RNA.
Replikace virové RNA je zahájena zkopírováním celého vlákna RNA (ovšem v komplementární podobě, tedy s v případě SARS-Cov-2 s negativní orientací). Tato kopie funguje jako šablona, dle které se generují pozitivně orientovaná vlákna RNA pro nové virové částice. Tato nová vlákna jsou ihned základem pro paralelně probíhající translaci, čímž se celý proces množení viru škáluje do šířky.
Přepis pozitivně orientované RNA do negativně orientované RNA a opět do pozitivně orientované RNA je dost komplikovaný, neprobíhá lineárně, a zahrnuje tvorbu asi osmi dílčích tzv. subgenomických mediátorových RNA (sg mRNAs) a to jak pozitivně, tak negativně orientovaných. Přepis probíhá částečně v již zmíněných DMVs, které jsou kanálky propojeny s buněčnou cytoplazmou, a částečně v endoplazmatickém retikulu.
V průběhu infekce hostitelské buňky je nejen zvýhodňována virová genetická informace na úkor buněčné genetické informace, ale zároveň je zpomalena nebo zastavena transkripce a replikace buněčné DNA. Mechanismus, kterým virus tento stav zabezpečí, je velmi komplexní, zahrnuje řadu faktorů a není zcela prozkoumán. Virus může například ovlivnit to, jak funguje buněčná proteáza nebo selektivně degradovat (rozrušovat) buněčnou vznikající mRNA.
6. Syntéza nových virionů a jejich uvolnění z buňky
Syntéza nových virionů a jejich uvolňování z buňky probíhá paralelně. Utváření virového obalu a skládání virionů je v infikované buňce zahájeno ve chvíli, kdy bylo vytvořeno dostatečné množství kopií virové RNA a strukturních proteinů, a pokračuje tak dlouho, dokud je infikovaná buňka metabolicky aktivní, čili dokud ji virus nezničí.
O molekulárním mechanismu kontrolujícím proces skládání virových částic je toho doposud velmi málo známo. Virus např. musí nějak poznat, kterou konkrétní RNA obalit (pomněme, že zlomků RNA může být v buňce velmi mnoho, protože v ní probíhá jak její vlastní dělení, tak třeba i jiné virové infekce). Pro toto rozpoznání je klíčový tzv. zabalovací signál (specifická sekvence virového genomu), který tu správnou RNA nade všechny pochybnosti identifikuje.
U viru SARS-Cov-2 se má za to, že syntéza nových virionů probíhá v modifikovaných buněčných membránách endoplazmatického retikula a Golgiho aparátu. Obalování virové RNA se spouští v těch místech membrán, kde jsou v nadlimitní koncentraci připraveny virové glykoproteiny. Při obalování dochází k interakci virového nukleoproteinu s buněčnou membránou, v kterémžto procesu jsou buněčné proteiny nahrazovány proteiny specifickými pro vir. Nicméně proces obalení není vždy bezchybný. Během směsné infekce dvěma kmeny téhož viru může dojít k výměně genomických segmentů mezi oběma kmeny (genetic reassortment) nebo zlomků vytvářených proteinů (fenotypové míšení).
Také proces zrání (maturace) nově poskládaných virových částic je doposud málo prostudovaný. Představuje strukturní změny v nezralé (neinfekční) virové částici, jejichž výsledkem je vznik zralého infekčního virionu.
Uvolnění viru z infikované buňky je nezbytné pro kolonizaci hostitele i pro další šíření viru. U viru SARS-COV-2 se má za to (ale výzkumy na toto téma stále běží), že existují dva mechanismy uvolnění viru. První a primární je tzv. exocytóza, alias pučení. Exotytóza je podobný proces jako již zmíněná endocytóza, jen probíhající v opačném směru. V endoplazmatickém retikulu nebo Golgiho aparátu vznikne jakýsi váček, obsahující nové virové částice, který je po aktinových filamentech dopraven k plazmatické membráně buňky. V místě kontaktu dojde k fúzi obou membrán a obsah váčku je uvolněn do bezprostředního okolí buňky.
Druhou cestou, o které se předpokládá, že ji viry SARS-COv-2 používají pro únik z hostitelské buňky, jsou trhliny v buněčné membráně (membrane ruptures). Zatímco první cesta je něco jako velký transportní tirák schopen najednou z buňky uvolnit stovky virů, druhá cesta je jako malé osobní auto využívané jen individuálními viriony.
Celý životní cyklus viru SARS-COV-2 pěkně graficky ilustruje obrázek níže (zdroj):
Závěr
Interakce viru SARS-COV-2 s hostitelskou buňkou je velmi složitý proces, v mnoha aspektech stále neprozkoumaný. Aby byl tento proces bezchybně dokončen, musí dojít ke splnění mnoha podmínek ve vzájemném sledu. To teoreticky skýtá mnoho možností, jak zvýšit odolnost hostitelského organismu proti infekci Covid-19, ať už skrze očkování, různá antivirotika, až po prosté zvýšení kondice našich buněk eliminací volných kyslíkových radikálů.